Cuprins
- 1.Noţiuni termodinamice generale
- 2.Caldura
- 3.Lucrul mecanic
- 4.Energia
- 5.Concluzii
- 6.Bibliografie
Extras din referat
1.Noţiuni termodinamice generale
Termodinamica studiază din punct de vedere energetic proprietăţile generale ale substanţelor şi legile care guvernează mişcarea termică, fără a se ţine seama de natura mişcărilor şi interacţiilor moleculare.
Metodele termodinamicii nu au la bază niciun model de reprezentare atomo-moleculară a substanţei şi din acest motiv termodinamica este o ştiinţă fenomenologică.
În cadrul termodinamicii se stabilesc relaţii între mărimi direct observabile, adică între mărimi măsurabile în experienţe macroscopice, cum ar fi volumul, presiunea, temperatură, concentraţia soluţiilor, intensitatea câmpului electric şi magnetic, etc.
Termodinamica operează cu o serie de noţiuni şi mărimi, cu ajutorul cărora se defineşte orice proces sau fenomen termic. Una dintre acestea este noţiunea de sistem termodinamic.
Sistemul termodinamic reprezintă un sistem fizic macroscopic ale cărui dimensiuni spaţiale şi existenţă în timp permit efectuarea unor procese normale de măsurare.
Sistemele termodinamice pot fi:
- izolate, dacă sistemul termodinamic nu suferă nicio interacţiune cu mediul înconjurător;
- închise, dacă există interacţiuni cu mediul înconjurător, dar nu există schimb de substanţă între sistem şi mediul înconjurător;
- deschise, dacă sistemul schimbă şi substanţă cu mediul înconjurător.
Starea unui sistem termodinamic poate fi complet caracterizată printr-un număr finit de parametrii, numiţi parametrii de stare.
Parametrii de stare reprezintă valorile instantanee ale mărimilor fizice ce caracterizează atât sistemul considerat cât şi interacţiunile dintre sistem şi mediul înconjurător.
Parametrii de stare ai unui sistem pot fi:
- interni, bj (j=1,2, ) care depind de proprietăţile interne ale sistemului, adică de mişcarea de ansamblu şi de distribuţia particulelor ce compun sistemul;
- externi, ai (i=1,2, ) care depind şi de poziţia corpurilor exterioare care nu fac parte din sistemul considerat.
Prin proces termodinamic se înţelege trecerea unui sistem termodinamic dintr-o stare de echilibru iniţială la o altă stare finală, trecând printr-o succesiune continuă de stări intermediare.
Clasificarea proceselor termodinamice se poate face din mai multe puncte de vedere.
a. După mărimea variaţiei relative a parametrilor de stare avem:
- procese diferenţiale, pentru care variaţia relativă a parametrilor de stare este foarte mică;
- procese finite, când cel puţin un parametru de stare suferă o variaţie relativ mare.
b. Din punctul de vedere al naturii stărilor intermediare:
- procese cvasistatice(de echilibru), în care stările intermediare pot fi considerate suficient de apropiate de stările de echilibru, în tot cursul procesului;
- procese nestatice, pentru care stările intermediare ale sistemului nu pot fi complet caracterizate din punct de vedere al termodinamicii.
c. Din punct de vedere al trecerii sistemului din starea iniţială I în starea finală F şi invers avem:
- procese termodinamice reversibile, dacă trecerea sistemului din starea I în starea F poate fi parcursă şi invers exact pe acelaşi drum.
Pentru realizarea unui astfel de proces, condiţiile exterioare trebuie să se modifice extrem de lent, astfel încât sistemul să aibă timp să se adapteze progresiv la noile variaţii la care este supus treptat;
- procese termodinamice ireversibile în care prin trecerea din starea F în starea I nu se ating toate punctele curbei obţinute la trecerea din starea I în starea F.
În realitate nu există procese reversibile.
d. După legătura dintre starea iniţială şi starea finală se disting:
- procese ciclice când starea finală a sistemului coincide cu cea iniţială;
- procese neciciclice (deschise), când starea finală a sistemului diferă de cea iniţială.
e. după parametrii ce rămân constanţi în timpul unui proces termodinamic avem:
- procese izobare (P=constant)
- procese izocore (V=constant)
- procese izoterme (T=constant)
- procese adiabatice (fără schimb de căldură cu exteriorul)
- procese politropice (când căldura specifică a sistemului rămâne constantă).
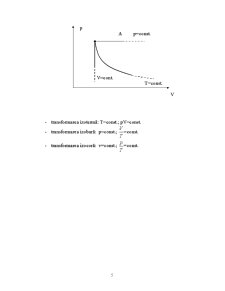
Când, la trecerea de la o stare la altă stare parametrii macroscopici variază toţi, transformarea se numeşte generală. Dacă unul din parametri rămâne constant atunci se obţin următoarele transformări particulare reprezentate şi în figură:
Preview document
Conținut arhivă zip
- Caldura, Energia si Lucrul Mecanic.doc