Extras din referat
1. Introducere
Stare naturală. Apa este una din cele mai răspândite substanţe în natură, găsindu-se în toate cele trei stări de agregare: solidă (gheaţă, zăpadă, grindină, chiciură), lichidă (apă de ploaie, ape subterane, oceane, mări, fluvii, râuri, lacuri, bălţi etc.) şi gazoasă (vaporii de apă din atmosferă şi emanaţiile vulcanice).
În natură nu există apă pură. Apele naturale conţin dizolvate cantităţi variate de diferite substanţe.
APA, H2O, masa mol. 18,02, lichid incolor, de culoare albastră-verzuie în straturi groase. Are structură unghiulară (A 104,5°), care în realitate este pseudo-tetraedrică, rezultată prin hibridizare sp3, molecula de apa dispunând de doi orbitali hibrizi ocupaţi cu câte o pereche de electroni neparticipanţi.
Timp de mai multe secole apa a fost considerată ca un element de sine stătător. Abia în anul 1781, N. Cavendish a arătat că apa se formează prin combinarea explozivă a hidrogenului cu oxigenul. Experienţa a fost repetată în anul 1783 de A. L. Lavoisier care a realizat pentru prima dată sinteza cantitativă a apei precum şi descompunerea acesteia la trecerea vaporilor săi peste un fier înroşit. Compoziţia în greutate a apei a fost determinată de G. Monge (1786), J. J. Berzelius şi P. L. Dulong (1820), iar compoziţia în volume de J. L. Gay Lussac şi A. von Humboldt (1805).
Hidrogenul şi oxigenul având mai mulţi izotopi, apa obişnuită conţine în proporţie mică şi combinaţiile reciproce ale aces¬tora : H216O ; H217O ; H218O ; HD16O ; HD17O ; HD18O; D216O ; D217O ; D218O şi T2O. Prezintă un pronunţat moment electric de dipol µ 1,84, fiind un bun solvent, capabil să funcţioneze ca donor de electroni. Dacă în stare de vapori apa este formată din molecule neasociate, în stare lichidă şi în gheaţă, ele sunt asociate prin legătura de hidrogen. Gheaţa cristalină are o structură afinată, cu simetrie hexagonală, analogă cu a β-tridimitului, în care orice moleculă de apa este coordinată de alte patru molecule de apa, respectiv fiecare atom de oxigen este înconjurat tetraedric de alţi patru atomi de oxigen întocmai ca atomii de carbon în diamant.
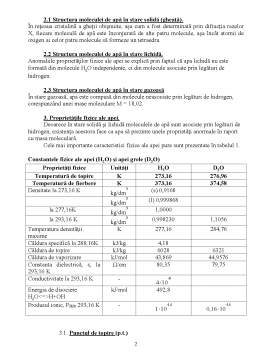
Stare de agregare Culoare Miros Gust Pt Pf Densitatea la 40C Conductibilitatea electrică
Lichid Incolor(în straturi groase este albastru) Inodor Insipid 00C 1000C 1g/cm3 izolator
2. Structura moleculei de apă
În molecula de apă, nucleele celor doi atomi de hidrogen formează cu nucleul atomului de oxigen un unghi de 104°54′. Această structură se poate explica , admiţând hibridizarea sp3 a atomului de oxigen. Din cei patru orbitali hibrizi sp3 echivalenţi, doi formează legături σ cu atomii de hidrogen (dH-O= 0,99 Å), iar ceilalţi doi sunt ocupaţi fiecare cu câte o pereche de electroni neparticipanţi.
2.1 Structura moleculei de apă în stare solidă (gheaţă).
În reţeaua cristalină a gheţii obişnuite, aşa cum a fost determinată prin difracţia razelor X, fiecare moleculă de apă este înconjurată de alte patru molecule, aşa încât atomii de oxigen ai celor patru molecule să formeze un tetraedru
2.2 Structura moleculei de apă în stare lichidă.
Anomaliile proprietăţilor fizice ale apei se explică prin faptul că apa lichidă nu este formată din molecule H2O independente, ci din molecule asociate prin legături de hidrogen.
2.3 Structura moleculei de apă în stare gazoasă
În stare gazoasă, apa este compusă din molecule neasociate prin legături de hidrogen, corespunzând unei mase moleculare M = 18,02.
3. Proprietăţile fizice ale apei.
Deoarece în stare solidă şi lichidă moleculele de apă sunt asociate prin legături de hidrogen, existenţa acestora face ca apa să prezinte unele proprietăţi anormale în raport cu masa moleculară.
Cele mai importante caracteristici fizice ale apei pure sunt prezentate în tabelul 1.
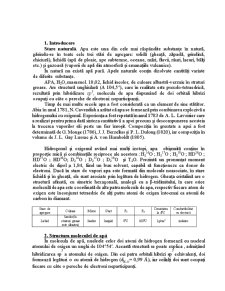
Constantele fizice ale apei (H2O) şi apei grele (D2O)
Proprietăţi fizice Unităţi H2O D2O
Temperatură de topire K 273,16 276,96
Temperatură de fierbere K 373,16 374,58
Densitate la 273,16 K kg/dm3 (s) 0,9168
kg/dm3 (l) 0,999868
la 277,16K kg/dm3 1,0000
la 293,16 K kg/dm3 0,998230 1,1056
Temperatura densităţii maxime K 277,16 284,76
Căldura specifică la 288,16K kJ/kg 4,18
Căldura de topire kJ/kg 6028 6321
Căldura de vaporizare kJ/mol 43,869 44,9576
Constanta dielectrică, ε, la 293,16 K Ω/cm 80,35 79,75
Conductivitate la 293,16 K - 4⋅10-8
Energia de disociere H2O<=>H+OH kJ/mol
492,8
Produsul ionic, PH20 293,16 K
- 1⋅10-14 0,16⋅10-14
Preview document
Conținut arhivă zip
- Anomaliile Apei.doc