Extras din referat
Datorită prezenţei solventului în mediul de reacţie, cinetica reacţiilor în soluţii prezintă o serie de specificităţi, întrucât moleculele reactante sunt înconjurate în orice moment de un număr variabil de molecule vecine, de la 4 la 12 ale solventului, ce poate împiedica mişcarea liberă. În practică există o varietate foarte mare de reacţii în soluţie.
O reacţie chimică ce se desfăşoară în soluţie poate să nu fie influenţată de prezenţa solventului,dacă acesta este în cantitate mare, în expresia vitezei concentraţia solventului nu apare, fiind practic constantă. În majoritatea cazurilor însă solventul influenţează mersul reacţiei, fie având rolul unui mediu fizic ce înconjoară moleculele de reactant, fie participând direct la schimbul chimic fără să se regenereze la sfârşitul procesului. Desfăţurarea unei reacţii în soluţie necesită succesiunea a trei procese, datorită efectului de cuşcă ce creează o barieră de potenţial:
ieşirea din cuşcă şi difuzia reactanţilor unul către celălalt;
reacţia propriu-zisă între reactanţi
difuzia produşilor cu refacerea cuştii în jurul moleculelor de produşi.
Efectul de cuşcă a fost dovedit experimental cu izotopi radioactivi şi are consecinţe importante, de exemplu în cazul reacţiilor fotochimice în soluţii. Conform teoriei ciocnirilor, o reacţie bimoleculară decurge în soluţie după schema,
k_d
A+B ⇆ [A…..B] □(□(→┴〖 k〗_(c ) )) P_r
k_(-d)
unde : [A…..B] este perechea de difuzie din cuşca solventului.
Viteza reacţiei este : 〖dc〗_Pr/dt=k_c (k_d c_A c_B)/(k_(-d)+k_c )
Când transformarea cinetică este lentă, comparativ cu difuzia k_d≫k_c:
〖dc〗_Pr/dt=k_c k_d/k_(-d)
Dar k_d/k_(-d) =k_[A….B] =0,4-1 M^(-1), iar ecuaţia de mai sus devine determinantă de viteză şi ia forma :
〖dc〗_Pr/dt=k_c c_A c_B
Când transformarea cinetică este foarte rapidă, comparativ cu difuzia, adică se produce la prima întâlnire a reactanţilor, k_c≫k_(-d):
〖dc〗_Pr/dt=k_(-d) c_A c_B
Viteza este determintă de difuzia reactanţilor în cuşca solventului. O tratare simplă a reacţiilor rapide controlate de difuziune, a realizat-o Smoluchowschi, prin ecuaţia ce îi poartă numele:
k_d=-8RT/3000η
unde ∶ η este coeficentul de vâscozitate.
Valoarea lui k_c este cuprinsă între 〖10〗^(9 )÷〖10〗^10 M^(-1) s^(-1) pentru reacţiile între molecule şi 〖10〗^10÷〖10〗^11 M^(-1) s^(-1) pentru reacţiile între ioni. Faţă de cele de mai sus şi ţinând cont de influenţa solventului, reacţiile chimice care decurg în soluţii se pot clasifica astfel:
reacţii foarte rapide care pot decurge fie între ioni, fie cu transfer de proton la un anion sau la o moleculă neutră, de exemplu
〖Ag〗^++Cl^-→AgCl
H_3 O^++〖OH〗^-→2H_2 O
reacţii rapide ce au o valoare mare a factorului steric (〖10〗^6÷〖10〗^8), care se petrec între ionii complecşi cu modificarea legăturilor covalente şi au reactivitate mare
[Cr(H_2 O)_6 ]^(3+)+〖CNS〗^-→produşi
reacţii normale ce au un factor steric de maxim 〖10〗^3 şi o energie de activare joasă. La aceste reacţii se înregistreză o scădere a constantei concentraţiei, de exemplu
C_2 H_5 ONa+〖CH〗_3 I→C_2 H_5 O〖CH〗_3+NaI
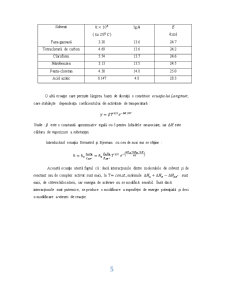
reacţii lente care au ca factor steric mai mic ca unitatea Menshutkin, este cel care a studiat astfel de reacţii, în mod special formarea sărurilor cuaternare de amoniu din amine terţiare şi halogenuri alcaline în diferiţi solvenţi. În tabelul de mai jos sunt redate rezultatele obţinute pentru constantele de viteză. Se poate observa influenţa naturii solventului asupra vitezei de reacţie.
Preview document
Conținut arhivă zip
- Cinetica Reactiilor in Solutie.docx