Extras din referat
Electroliza este procesul de orientare și separare a ionilor unui electrolit (substanță a cărei molecule prin dizolvare sau topire se disociază în ioni, permițând trecerea curentului electric continuu) cu ajutorul curentului electric continuu.
În procesul de electroliză, ionii pozitivi sau cationii sunt dirijați înspre catod (pol negativ), iar ionii negativi sau anionii înspre anod (pol pozitiv) unde își pierd sarcina și se depun sau intră în reacție chimică. Specificăm că la anod există un proces de oxidare, în timp ce la catod unul de reducere.
Figura 1.Reprezentarea schematică a unei instalaţii de electroliză
Figura 2. Electrozi bidimensionali
Catozi de aluminiu
Catozi de cupru
Anod de nichel
Anod de cupru
Anozi de titan
Electroliza apei
Această formă a obținerii hidrogenului din apă a fost pentru prima dată evidențiată de chimistul german Johann Wilhelm Ritter în jurul anului 1800, și se pare că pe termen lung este singurul procedeu rațional, deoarece în cursul procesului nu se emite CO2. Ca exemplu se poate aminti electroliza în mediu bazic, care datorită prețurilor mici este utilizată adeseori în combinație cu centrale hidroelectrice în Norvegia și Islanda. Reacția are loc într-un recipient umplut cu electrolit bun conductor de curent (sare, acid, bază), în care se găsesc doi electrozi printre care circulă un curent continuu. Procesul poate fi descries prin două reacții parțiale.
Catod: 2H2O+2e- H2+2OH-
Anod: 2H2O O2+4H+ +4e-
În principiu la anod se eliberează electroni care mai apoi sunt captați la catod. Din aceste două procese parțiale rezultă de fapt reacția de separare a atomilor de oxigen și hidrogen din apă.
Reacția de separare: 2H2O 2H2+O2
Procesul este deosebit de avantajos pentru că pe lângă hidrogen și oxigenul rezultat se poate utiliza efficient în alte procese tehnologie, nefiind lăsat liber în atmosferă.. Există aparate de electroliză industrială cu presiune înaltă cu o capacitate de producție de 60 Nm³/h la o presiune de 12bar.
Modul de lucru
În celula de electroliza se introduce o soluia apoasa de KOH 25% si se realizeaza montajul din Figura 3. Se umple coloana de lichid a eudiometrului si se conecteaza sursa de curent si aparatele de masura. Ampermetrul digital (7) se fixeaza pe domeniul 200 mA (DC) iar voltmetrul digital (6) se fixeaza domeniul 2000 mV (DC) când se masoara potentialele anodice si catodice, respectiv pe domeniul de 20 V când se masoara tensiunea la bornele reactorului. Se efectueaza 2-4 teste cu o durata de 10 - 30 min, la densitati de curent cuprinse între 1 si 5 A/dm2 (50 - 200 mA). Se mentine constanta intensitatea de curent si se citesc din 5 în 5 min. potentialele celor doi electrozi si tensiunea la borne. La sfârsitul fiecarui test se masoara, dupa cca. 5 minute, volumul de hidrogen acumulat în eudiometru.
Figura 3. Instalatia de laborator pentru electroliza apei:
1.sursa de curent continuu stabilizata
2.celula de electroliza;
3.catod;
4.anod;
5.electrod de referinta (ECS);
6.voltmetru digital;
7.ampermetru digital;
8.capilare Luggin;
9.eudiometru;
10.separator interpolar;
11.comutator dublu.
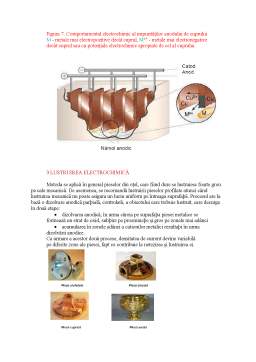
APLICAȚII ALE ELECTROLIZEI
Electroliza se folosește cu preponderență în următoarele scopuri:
1.Obținerea electrochimică a unor substanțe:
● Metale: Cu, Ag, Au, Pb, Al, Ni, Cr, Zn, metalele alcaline, etc.
● Nemetale: O2, H2, X2;
2.Rafinarea electrochimică a metalelor (Cu, Au, Ag, etc.)
3.Lustruire electrochimică;
4.Galvanotehnică.
1.OBȚINEREA ELECTROCHIMICĂ A UNOR SUBSTANEȚE
1.1 Obţinerea electrochimică a cuprului se face în instalația de electroliză
prezentatã în Figura 4, folosind ca electrolit o soluție de CuSO4 acidulată cu
H2SO4 pentru creșterea conductivității electrice. Catodul este confecționat din tablă
subțire de cupru, iar anodul dintr-o foițã de plumb-antimoniu.
Preview document
Conținut arhivă zip
- Electroliza si Aplicatiile Ei Practice.doc