Extras din referat
Elementele cu caracter metalic sunt cele mai numeroase elemente, iar proprietăţile lor au o importanţă fundamentală pentru industrie, agricultură, mediu, pentru activitatea de cercetare. Multe din proprietăţile metalelor din blocul s variază sistematic în interiorul blocului. În acest capitol se prezintă, în general, variaţia periodică a proprietăţilor chimice funcţie de stabilitatea stărilor de oxidare a metalelor, funcţie de formarea combinaţiilor complexe, destul de rare, datorită caracterului slab al legăturilor formate de ionii metalelor din blocul s cu diverşi liganzi, sau de compuşi binari simpli, cum ar fi oxizii metalici. Numerele de oxidare caracteristice ale elementelor din blocul s sunt identice cu numerele grupei din care fac parte: +1 pentru metalele alcaline şi +2 pentru metalele alcalino-pământoase. Metalele mai ieftine (litiul, sodiul, potasiul şi calciul) sunt folosite ca agenţi reducători puternici pentru reacţii chimice conduse în solvenţi neapoşi. Cationii metalelor alcaline şi cei ai metalelor alcalino-pământoase se găsesc în mod obişnuit în minerale şi ape naturale, iar unii dintre aceştia sunt constituenţi importanţi ai fluidelor biologice, cum este sângele.
Metalele alcaline
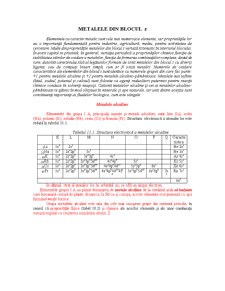
Elementele din grupa I A, principală, numite şi metale alcaline, sunt: litiu (Li), sodiu (Na), potasiu (K), rubidiu (Rb), cesiu (Cs) şi franciu (Fr). Structura electronică a atomilor lor este redată în tabelul 11.1:
Tabelul 11.1. Structura electronică a metalelor alcaline
K L M N O P Q
Caracteristica
3Li 1s2 2s1 He 2s1
11Na 1s2 2s22p6 3s1 Ne 3s1
19K 1s2 2s22p6 3s23p6 4s1 Ar 4s1
37Rb 1s2 2s22p6 3s23p63d10 4s24p6 5s1 Kr 5s1
55Cs 1s2 2s22p6 3s23p63d10 4s24p64d10 5s25p6 6s1 Xe 6s1
97Fr 1s2 2s22p6 3s23p63d10 4s24p64d104f14 5s25p65d10 6s26p6 7s1 Rn 7s1
ns1
În ultimul strat al atomilor lor, în orbitalul ns, se află un singur electron.
Elementele grupei I A au primit denumirea de metale alcaline de la cuvântul arab al kalyum care înseamnă cenuşă de plante deoarece, la fel ca şi cenuşa, aceste elemente reacţionează cu apa formând medii bazice.
Grupa metalelor alcaline este una din cele mai omogene grupe din sistemul periodic, în sensul că proprietăţile fizice (tabel 10.2) şi chimice ale acestor elemente şi ale unor combinaţii variază regulat cu creşterea numărului atomic Z.
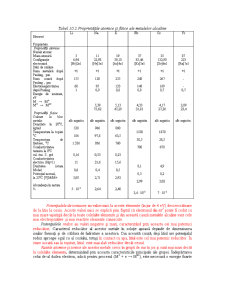
Tabel 10.2.Proprietăţile atomice şi fizice ale metalelor alcaline
Element
Proprietate Li Na K Rb Cs Fr
Proprietăţi atomice
Număr atomic
Masa atomică
Configuraţie electronică
Stări de oxidare
Raza metalică după Pauling, pm
Raza ionică după Pauling , pm
Electronegativitatea după Pauling
Energie de ionizare, eV
M → M+
M+ → M2+
Proprietăţi fizice
Culoare în bloc metalic
Densitate la 200C, kg/m3
Temperatura la topire 0C
Temperatura de fierbere, 0C
Conductivitatea termica la 00C
cal. ∕cm. S . grd
Conductivitatea electrica (Hg=1)
Duritatea (scara Mohs)
Potenţial normal,
la 250C [V]M/M+
Abundenţa în natura %
3
6,94
[He]2s1
+1
155
60
1
alb argintiu
530
186
1.336
0,16
11
0,6
3,05
5 ∙ 10-3
11
22,98
[Ne]3s1
+1
120
95
0,9
5,39
75,62
alb argintiu
966
97,8
886
0,33
21,6
0,4
2,71
2,64
19
39,10
[Ar]4s1
+1
235
133
0,8
5,13
47,29
alb argintiu
860
63,5
760
0,23
15,6
0,5
2,92
2,40
37
85,46
[Kr]5s1
+1
248
148
0,8
4,33
31,81
alb argintiu
1530
38,5
700
8,1
0,3
2,99
3,4 ∙ 10-3
35
132,90
[Xe]6s1
+1
267
169
0,7
4,17
27,36
alb argintiu
1870
28,5
670
4,9
0,2
3,02
7 ∙ 10-5
87
223
[Rn]7s1
+1
-
-
0,7
3,89
23,4
alb argintiu
Potenţialele de ionizare au valori mici la aceste elemente (în jur de 4 eV) descrescătoare de la litiu la cesiu. Aceste valori mici se explică prin faptul că electronul din ns1 poate fi cedat cu mai mare uşurinţă decât la toate celelalte elemente şi din această cauză metalele alcaline sunt cele mai electropozitive şi mai reactive elemente cunoscute.
Preview document
Conținut arhivă zip
- Metalele Blocului S.doc