Extras din referat
În cinetica reacţiilor chimice studiul se desfasoară succesiv sau consecutiv având rol foarte important pentru obţinerea unui produs intermediar al cărui randament să fie maxim sau pentru precizarea vitezei de formare a produsului final.
De multe ori studiul reacţiilor succesive poate merge până la reacţii elementare deşi de obicei o reacţie complexă e redusă la o succesiune de reacţii cu o cinetică simplă.
Reacţiile izolate -reprezintă acele reacţii care se succed şi formează o succesiune de alte reacţii denumite Etape
-pot avea diferite ordine ca şi diferite constante de viteză
Un exemplu de reacţii consecutive este reprezentat schematic mai jos astfel:
Astfel considerăm că la timpul t = 0, concentraţia lui A este a iar cea a substanţelor B respectiv C este zero. Presupunând un timp oarecare “ t ” concentraţia lui A este (a + x) , a lui B este “ y “ iar cea a lui C este “ z “ şi astfe se poate determia concentraţia direct sau dacă se conoaşte concentraţia celorlalte două B sau C.
Cele trei viteze sunt legate prin relaţia:
Dacă rezultă că prin integrare conduce la: care inlocuită în va rezulta , ecuaţie care este neomogenă de gradul 1 cu o soluţie generală de forma: unde α si β reprezintă constante ce se pot determina astfel:
Prin introducerea ultimelor două ecuaţii în ecuaţia se obţine .
Parametrul α astfel obţinut se înlocuieşte în ecuaţia şi se obţine ecuaţia .
Ştiind din condiţiile iniţiale că t=0, şi y=0, se obţine ecuaţia , care ajută în acest caz la obţinerea relaţiei pentru concentraţia intermediarului B:
În final se poate obţine concentraţia constituentului
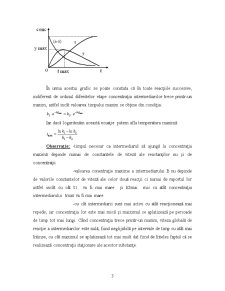
Astfel se pot reprezenta curbe cinetice pentru reacţii succesive pentru curbele (a + x) , y şi z depinzând de timpul corespunzător:
În urma acestui grafic se poate constata că în toate reacţiile succesive, indiferent de ordinul diferitelor etape concentraţia intermediarilor trece printr-un maxim, astfel incât valoarea timpului maxim se obţine din condiţia:
Iar dacă logaritmăm această ecuaţie putem afla temperatura maximă:
Observaţie: -timpul necesar ca intermediarul să ajungă la concentraţia maximă depinde numai de constantele de viteză ale reactanţilor nu şi de concentraţii
-valoarea conentraţie maxime a intermediarului B nu depinde de valorile constantelor de viteză ale celor două reacţii ci numai de raportul lor astfel incât cu cât t1 va fi mai mare şi k2mai mic cu atât concentraţia intermediarului tmax va fi mai mare.
Preview document
Conținut arhivă zip
- Cinetica Reactiilor.doc